خواص الماء: النظائر والتركيب الجزيئي.
خواص الماء 1: عام
خواص الماء 2: الخواص الفيزيائية والكيميائية
التركيب النظيري للماء
الماء عبارة عن مزيج من مجموعات مختلفة من نظائر الأكسجين والهيدروجين تختلف عن بعضها البعض في عدد النيوترونات المرتبطة بالبروتونات في النواة.
1H,2 H (الديوتيريوم)3ح (التريتيوم)
16O, 17O,18O.
نسب النظائر هي كما يلي:
للهيدروجين:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
التريتيوم عنصر غير مستقر ، وعمر النصف هو سنوات 12,5.
للأكسجين:
18O/16O = 1 / 500
17O/16O = 1 / 2500
الأنواع الجزيئية الرئيسية 4 وتردداتها هي كما يلي:
1H216O = 99,7٪
1H2 18 O = 0,2٪
1H217O = 0,04٪
1HD16O = 0,03٪
D216يا = ضعيف جدا
تثير النظائر المختلفة اختلافات في الخواص الفيزيائية للجزيئات ، ولا سيما كثافتها ، لكن الخواص الكيميائية تظل كما هي.
الماء الثقيل د2O موجود في حالته الطبيعية ولكن في غاية
منخفض. للحصول على كمية ملحوظة ، من الضروري إتقان تقنيات فصل النظائر: كان هذا أحد التحديات الأساسية خلال الحرب العالمية الأخيرة لإعداد السلاح الذري.
يتم استخدام التركيب النظيري للمكونات الكيميائية للماء في تقدير المعلمات الديناميكية الحرارية مثل درجة الحرارة ؛
تقرير 18 O/16O يوفر الجليد من القمم القطبية والمياه من المياه الجوفية الأحفورية معلومات عن مناخ الماضي.
يحدث تبخر مياه المحيط مع التجزئة النظيرية: يفضل أن يتبخر نظير الأكسجين إلى النظير الثقيل. المحيطات أكثر ثراءً بالنظائر الثقيلة من الماء من السحب وهطول الأمطار.
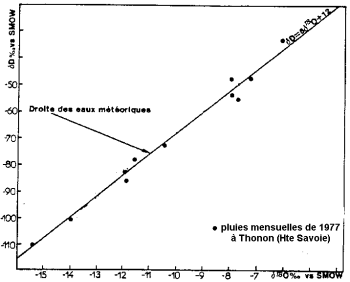
محتوى النظائر المستقرة للترسيب (بعد Blavoux and Letolle ، 1995).
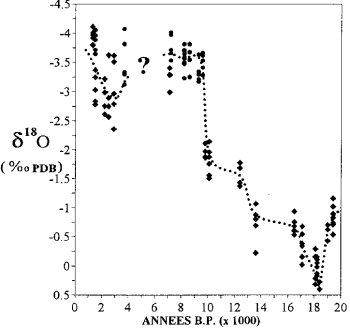
التباين في محتوى نظائر الأكسجين في الشعاب المرجانية في مايوت (بعد كازانوفا وآخرون ، 1994).
هيكل الجزيء
تجمع ذرات الهيدروجين والأكسجين إلكتروناتها لتشكيل طبقة كاملة مثل طبقة النيون. في الواقع ، تفتقر ذرة الأكسجين إلى إلكترونين لإكمال غلافها الإلكتروني ، وهما ذرتا الهيدروجين التي توفرها. يتكون جزيء H2O المستقر.
الأكسجين: بروتونات 8 + نيوترونات 8
الهيدروجين: 2 (2 * (1 proton + 1 neutron))
المجموع: بروتونات 10 التي توازن بين شحنة إلكترونات 10.
نوى الهيدروجين لها جانب واحد من الأكسجين لتشكيل "رأس ميكي" (الهيدروجين هو الأذنين).
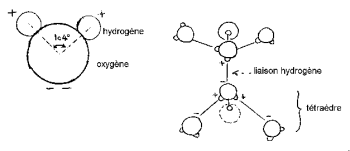
تبلغ زاوية HOH 104,474 درجة (سمة من سمات الهندسة رباعية السطوح). المسافة بين ذرة الأكسجين والهيدروجين قريبة من 1 درجة (0,95718 درجة) في البخار. يبلغ قطر الجزيء الفعال 2,82 درجة مئوية.
يتم توزيع الشحنات الكهربائية بشكل غير متساو في هذا الجزيء الصغير. تنجذب الإلكترونات إلى ذرة الأكسجين بقوة أكبر من انجذابها إلى ذرة الهيدروجين. يوجد مركزان للشحنات الموجبة بالقرب من نواة الهيدروجين ومركزان للشحنات السالبة بالقرب من نواة الأكسجين. يتجلى هذا الخلل في توزيع الشحنات ، جنبًا إلى جنب مع الهندسة غير الخطية لجزيء الماء ، في وجود عزم كهربائي ثنائي القطب قوي. جزيء الماء قطبي. إنه يتصرف مثل ثنائي القطب الكهربائي الذي يمكنه بالتالي الارتباط بجزيئات قطبية أخرى. في الواقع ، يمكن إدخال جزيئات الماء بين الأيونات المكونة للبلورة عن طريق توجيه الجزء المقابل من الشحنة الكهربائية تجاهها. يضعف جاذبية الأيونات البلورية بشكل كبير ويقل تماسك البلورة ، مما يسهل انحلالها. توضح الخصائص القطبية لجزيء الماء تقنية تسخين الميكروويف. في الواقع ، يوجه الجزيء المستقطب نفسه بالنسبة إلى مجال كهربائي ؛ إذا اختلف هذا ، فإن الجزيء يتبع التغيير في الاتجاه. من تردد معين ، بضعة غيغاهرتز للمياه ، تنتج حركات الجزيئات حرارة عن طريق الاحتكاك. تعمل الأفران المنزلية عادةً على تردد 2 جيجاهرتز ، وهو UHF.
النوى الثلاثة للجزيء ليست ثابتة ، فهي تتحرك بالنسبة لبعضها البعض ، ويهتز الجزيء ويلتوي. في الماء السائل ، تميل الجزيئات إلى الارتباط: يربط رأس ميكي الأذن بالذقن عن طريق الرابطة الهيدروجينية. في الواقع ، من بين 3 إلكترونات محيطية للأكسجين ، هناك 8 فقط منخرطة في الروابط التساهمية مع ذرات الهيدروجين. يتم تجميع الإلكترونات الأربعة المتبقية في أزواج تسمى مضاعفات الإلكترون الحرة. يمكن لكل من هذه المضاعفات المشحونة كهربائياً أن تشكل رابطة إلكتروستاتيكية مع ذرة هيدروجين موجبة الشحنة لجزيء ماء قريب. رابطة الهيدروجين ، المستقرة في درجة حرارة الغرفة ، هشة مقارنة بالرابطة التساهمية. في جزيء الماء ، تكون الهندسة المتكونة من اتجاه الرابطتين التساهميتين والمزدوجين الإلكترونيين الحرين قريبين من تلك الموجودة في رباعي السطوح الذي يشغل مركزه نواة الأكسجين.
ومع ذلك ، لا يزال التركيب الواسع النطاق لجزيء الماء معروفًا بشكل غير كامل. يوفر أطياف الأشعة السينية وحيود النيوترونات قيمتين رئيسيتين: إشارة تقابل 2 درجة مئوية ، والمسافة بين نوى الهيدروجين والأكسجين ، وقيمة من 1 إلى 2,84 درجة مئوية متغيرة وفقًا لدرجة الحرارة و المقابلة للمسافة بين نواتين أكسجين. يتيح قياس حيود RX أيضًا إمكانية معرفة متوسط عدد الجزيئات لكل وحدة حجم للسائل الموجود على مسافة R من جزيء معين. يبلغ متوسط جزيء الماء 4 جيرانًا ، مما يوحي بوجود شبكة رباعية السطوح. بالإضافة إلى الجزيئات المرتبطة بروابط هيدروجينية ، هناك جزيئات أخرى غير منضمة ، والتي قد تفسر سبب زيادة عدد الجزيئات المجاورة قليلاً عن 2 ، وليس 4,4 تمامًا كما هو مطلوب في حالة تبلور صارمة رباعية السطوح. ستشكل الشبكة البلورية للجزيئات المرتبطة بروابط هيدروجين تجاويف حيث ستوضع الجزيئات غير المرتبطة. تعتمد فرضية أخرى على تشويه الروابط الهيدروجينية. هذا الأخير ، الخطي في الأصل ، أي مع محاذاة ذرات O - H O ، يمكن أن ينحرف بدرجات متفاوتة ويسمح للجزيئات التي تكون أبعد من الجيران القريبين بالاقتراب من الجزيء المركزي.
تم تطوير النماذج النظرية مؤخرًا باستخدام أجهزة كمبيوتر قوية. تشير إلى أن حوالي 80٪ من جزيئات الماء متورطة في 3 أو 4 روابط هيدروجينية ؛ من ناحية أخرى ، فإنها تستبعد وجود جزيئات غير مرتبطة. تشير النمذجة الحاسوبية إلى أنه مع برودة الماء ، أصبحت شبكات الجزيئات تشبه بشكل متزايد الأشكال السداسية المشابهة لتلك الموجودة في الجليد.
تتوافق الحالة الصلبة مع ترتيب بلوري أكثر صرامة. في الضغط العادي ، يكون للجليد هيكل سداسي. عند درجة حرارة منخفضة (أقل من -80 درجة مئوية) ، يمكن أن يأخذ شكل مكعب. يمكن أن تتحرك الشحنات الكهربائية في الشبكة البلورية وتنتج عيوبًا بلورية من النوع الأيوني: البروتون المائي H3O + وأيون الهيدروكسيل OH-. لا تتوافق الشبكة البلورية للجليد مع تكديس الجزيئات الأكثر إحكاما. عند الاندماج ، تنهار العيوب لأن الروابط الهيدروجينية تنكسر وتقترب الجزيئات من بعضها: تزداد الكثافة إلى حد أقصى عند 4 درجات مئوية. وبالتالي ، في الماء السائل ، تدفع الزيادة في درجة الحرارة الجزيئات بعيدًا وتقل الكثافة.
لمعرفة المزيد ، المراجع والببليوغرافيا:
Blavoux B. and Letolle R. (1995) - مساهمة التقنيات النظيرية في معرفة المياه الجوفية. Geochronics ، 54 ، ص. 12-15.
Caro P. (1990) - الخصائص الفيزيائية والكيميائية للماء. كتاب الماء العظيم ، لا فيليت ، ص. 183-194.
إيجلاند د. (1990) - هيكل المياه. البحث ، 221 ، ص. 548-552.
ميدمينت DR (1992) - كتيب الهيدروجيولوجيا. ماك جراو هيل.
Casanova J.، Colonna M. and Djerroud K. (1994) - Geoprospective - paleoclimatology. راب. عالم. BRGM ، ص. 76-79.

